| Thema: Reaktionen von Metallen und Metallverbindungen sowie von Nichtmetallen (Ammoniak) | Tags: Legierung, Messing, Metalle | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
200 mL Becherglas, Tiegelzange, Magnetrührer mit Rührfisch, Thermometer, Gasbrenner, 100 mL Messzylinder, Spatel
Chemikalien
Zinkpulver, 2-molare Kaliumhydroxid-Lösung, 1-Cent- und 2-Cent-Münzen
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Zink Pulver | H410 | -- |  |
| Kalilauge 1 M | H302-H314 | P280-P305+P351+P338-P310 |   |
Durchführung
In einem Becherglas werden 2-3 g Zinkstaub mit etwa 80 mL Kalilauge (Kaliumhydroxid-Lösung) versetzt und auf ca. 60 °C erhitzt. Anschließend wird eine Kupfermünze für 2-3 Minuten in die Lösung gehalten. Das Ergebnis verbessert sich bei längerer Einwirkzeit. Nach dem Herausnehmen der Münze wird diese zunächst gründlich mit viel demineralisiertem Wasser abgespült und anschließend mehrmals durch die rauschende Gasbrennerflamme gezogen. Sobald sich die Münze golden verfärbt, sollte man das Erhitzen in der Brennerflamme beenden.
Beobachtung
Nach mehreren Minuten in der erhitzten alkalischen Zinkpulver-Suspension bildet sich eine graue, metallische Schicht auf der Münze. Nach dem Erhitzen in der Brennerflamme ist die Münze goldfarben.
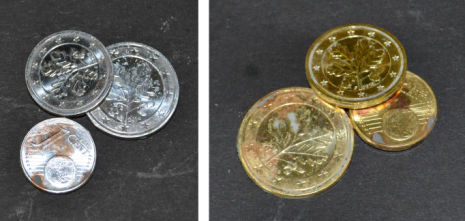
Deutung
In der alkalischen Zinkpulver-Suspension bildet sich auf der Münze eine Zinkschicht.
In der Brennerflamme reagiert die Zinkschicht mit der Kupferschicht der Münze zu einer Messinglegierung.
Zink + Kupfer → Messing
Entsorgung
Die Lösung wird im Schwermetallbehälter entsorgt.
Die Reaktionsgleichung für die Ablagerung des Zinks auf der Münze ist ein Prozess, bei dem Komplexe auftreten (der Hexahydroxidozinkat-Komplex hat ein höheres Standardpotential als Kupfer). An dieser Stelle ist eine didaktische Reduktion notwendig. Da die SuS in den Klassen 9 und 10 lernen, dass Kupfer edler ist als Zink und die Ergebnisse des Versuchs in einem scheinbaren Widerspruch dazu stehen (es lagert sich eine metallische Schicht auf der Kupfermünze ab), wird hier die Wortgleichung ebenfalls nicht aufgeschrieben.
Zur Überprüfung, ob Kupfer der weitere Bestandteil der Legierung ist, kann das Experiment auch mit anderen Münzen durchgeführt werden und ein Vergleich der entstehenden Legierungen gezogen werden.
Im Anschluss an dieses Experiment können weitere Legierungen im Unterricht thematisiert werden.
Literatur
X-Lab Skript Metalle mal anders
G. Graeb, E. Otto, H. Rampf, K. Weber, Experimentelle Schulchemie – Anorganische Chemie Metalle 3, Aulis Verlag, 1977, S. 138.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.