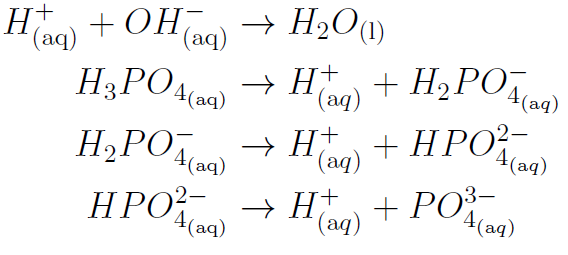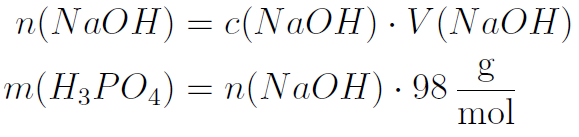| Thema: Titrationen (Alltagschemikalien) | Tags: Cola, Titration, Leitfähigkeit | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
Magnetrührer mit Heizplatte; 50 mL Bürette; Becherglas (250 mL); Leitfähigkeitsprüfer; Voltmeter
Chemikalien
Cola, 0,1 M NaOH
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Cola | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
| Natronlauge | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
Durchführung
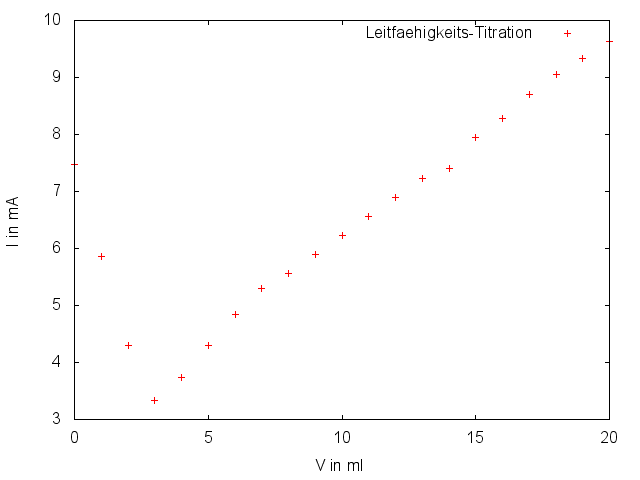
50 mL Cola werden in das Becherglas gegeben und unter Erhitzen ca. 10 Minuten lang gerührt, damit die Kohlensäure entweicht. Danach wird ein Leitfähigkeitsprüfer in die Lösung gehalten und vorsichtig die Natronlauge hinzu titriert, bis die auf dem Voltmeter angezeigte Stromstärke über die Zugabe von mindestens 5 mL hinweg konstant gestiegen ist. Für jeden Milliliter wird die entsprechende Stromstärke notiert.
Beobachtung
Nach anfänglichem Sinken des Wertes steigt er nach kurzer Zeit wieder an. Je nach Genauigkeit der Messung kann es sein, dass die Funktion der Stromstärke zwei Mal die Steigung ändert.
Deutung
Die zugetropfte Natronlauge (bzw. die Hydroxid-Ionen) reagieren mit der der Phosphorsäure der Cola (bzw. mit den Hydroxonium-Ionen) in einer Neutralisationsreaktion (also zu Wasser und sind damit ungeladen). Da diese besser leiten als die zugehörigen Kat- und Anionen (Na+ bzw. HxPO4(3-x)-) nimmt die Leitfähigkeit der Lösung zu Beginn ab. Nach dem Äquivalenzpunkt, bei dem gleich viele Hydroxonium- und Hydroxid-Ionen vorliegen (bei dem Minimum der Leitfähigkeit), steigt die Leitfähigkeit wegen der Zugabe weiterer Hydroxonium-Ionen wieder an. Die Änderungen der Steigung sind auf das weitere Dissoziieren der Phosphorsäure bei dem entsprechenden pH-Wert zurückzuführen.
Die Menge der Phosphorsäure kann über die zugegebene Menge von Natronlauge am ÄP bestimmt werden, indem die Stoffmenge mit der Molmasse der Säure (98 g/mol) multipliziert wird. Das Ergebnis muss dann noch auf 100 mL Probe umgerechnet werden (was bei 50 mL Probe bedeutet, dass es verdoppelt werden muss). Die Menge sollte in etwa zwischen 50 mg/100 mL und 80 mg/100 mL liegen.
Entsorgung
Die Lösungen können, mit Wasser verdünnt, über den Abfluss entsorgt werden.
Literatur
-
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.