| Thema: Titrationen (Alltagschemikalien) | Tags: Säure-Base, Titration, Zitronensaft | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
Magnetrührer mit Heizplatte; 50 mL Bürette; Becherglas (250 mL), pH-Meter
Chemikalien
Zitronensaft; 0,1 NaOH; Phenolphthalein-Lösung
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Citronensäure | H318 | P280-P305+P351+P338-P309+P310 |  |
| Natronlauge 0,1 M | H314 | P280-P305+P351+P338-P310 |  |
| Phenolphthalein | H350-H341-H361f | -- |  |
Durchführung
Eine kleine Menge (10 mL) Zitronensaft wird nach Filtrieren in dem Becherglas auf 50 mL verdünnt und mit dem pH-Meter der pH-Wert der Lösung bestimmt. Nun werden wenige Tropfen Phenolphthalein zu der Lösung hinzugegeben und die Lösung in 1 mL Schritten mit der Natronlauge titriert. Die Änderung des pH-Wertes wird notiert. Gegebenenfalls kann die Schrittgröße auch vorsichtig erhöht werden. Dabei muss aber jederzeit mit einem plötzlichen Anstieg gerechnet und die Titration gestoppt werden.
Beobachtung
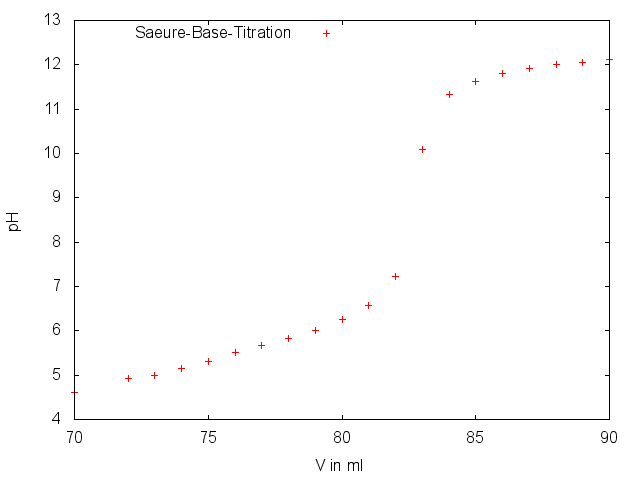
Während der pH-Wert (zu Beginn ca. 2,4) nur sehr langsam steigt, beschleunigt sich dieser Anstieg ab einem Wert von ca. 6-7 deutlich und springt nahezu auf 11-12.
Deutung
Ähnlich wie bei V1 findet auch hier wieder eine Neutralisationsreaktion statt.
H+(aq) + OH-(aq) → H2O(l)
Am ÄP, wo die Mengen der Ionen gleich sind, kann über die bekannte Menge der Hydroxid-Ionen die Menge der Citrat-Ionen bestimmt werden. Zu beachten ist allerdings, dass bei diesem pH-Wert die Zitronensäure dreifach dissoziiert ist (an der Strukturformel kann gesehen werden, dass Zitronensäure drei Carboxylgruppen aufweist und daher dreiprotonig ist) und daher drei Mol Natronlauge nur einem Mol Zitronensäure entsprechen.
Mit der Menge der Citrat-Ionen kann über die Molmasse (M=192 g/mol) nun auch die Menge der Zitronensäure pro 100 mL errechnet werden:
m(C6H8O7) = n(C6H5O73-) · 192 g/mol
Der mit dieser Gleichung erhaltene Wert muss noch auf 100 mL umgerechnet werden (bei dem Einsatz von 10 mL also mit 10 multipliziert werden).
Diese sollte zwischen ca. 3 g/100 mL und 7 g/100 mL liegen.
Alternativen:
Alternativ, um den Versuch zu beschleunigen, kann auch mit 0,5 molarer Natronlauge titriert werden.
Entsorgung
Die Lösungen werden über den Säure-Base-Behälter entsorgt.
Literatur
-
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.