| Thema: Titrationen (Alltagschemikalien) | Tags: EDTA, Titration, Wasserhärte | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
Magnetrührer mit Heizplatte; 50 mL Bürette; Becherglas (250 mL), Leitfähigkeitsmesser; Voltmeter
Chemikalien
0,01 M NaH2EDTA-Lösung; (Leitungs-)Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Dinatrium-ethylendiamin-tetraessigsäure | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
Durchführung
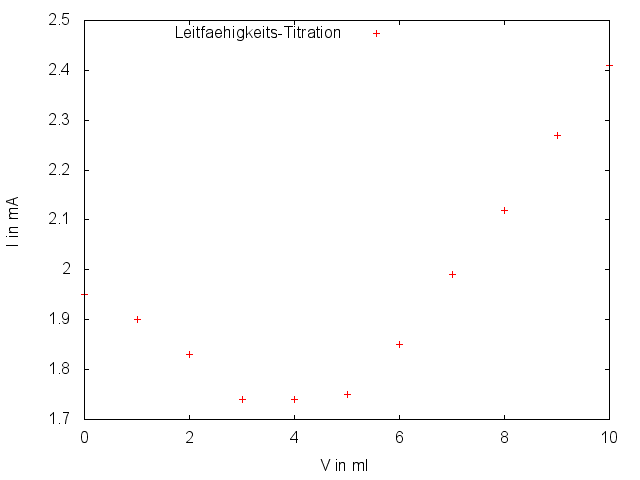
50 mL einer beliebigen Wasserprobe werden mit der EDTA-Lösung titriert und die Veränderung der Leitfähigkeit des Wassers beobachtet und in 1 mL Schritten protokolliert.
Beobachtung
Nach anfänglichem Sinken der Leitfähigkeit erreicht sie nach wenigen Milliliter EDTA-Lösung ein Minimum und steigt danach konstant.
Deutung
Zu Beginn sinkt die Leitfähigkeit der Probe, da einige der leitenden Ionen der Lösung gebunden (komplexiert) werden. Nach Erreichen des ÄP steigt die Leitfähigkeit der Lösung, da das hinzugegebene EDTA dissoziiert und dabei Hydronium-Ionen freisetzt.
H2(edta)2-(aq) → edta4-(aq) + 2H+(aq)
Über die Menge der eingesetzten EDTA-Lösung kann auf die Menge der Calcium- und Magnesium-Ionen geschlossen damit dann die Wasserhärte (in Deutschland definiert als [m(CaO)/10 mg/L) + m(MgO/7 mg/L)] bestimmt werden. Dies ist möglich, da jedes EDTA-Molekül eine Verbindung mit jeweils einem Magnesium- bzw. Calcium-Ion bildet. Für die Berechnung: siehe Abbildung 2
Das Ergebnis dieser Rechnung muss noch mit 100 multipliziert werden (wegen der Umrechnung von g zu mg und der /10 aus der Definition der °dH). In Göttingen beträgt diese ca. 4 °dH -7° dH (bei der Beispielrechnung entsprechend 4,5 °dH).
Entsorgung
Die Lösung kann über den Abfluss entsorgt werden.
Literatur
Northolz, M., & Herbst-Irmer, R. (2009). Skript zum anorganisch-chemischen Grundpraktikum für Lehramtskandidaten. Göttingen: Universität Göttingen. S. 147.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.