| Thema: Halogene, Nachweise in Alltagsprodukten | Tags: Halogene, Nachweis, Fluorid-Ionen | Klassenstufen: 9-10 | Versuchsart: SV |
Materialien
3 Bechergläser (50 mL), 6 Reagenzgläser, Pasteurpipetten, Pipettierhilfe, Reagenzglasständer.
Chemikalien
Eisen(III)-chloridlösung (c = 0,1 mol/L), Ammoniumthiocyanatlösung (c = 0,1 mol/L), Zahncreme mit Fluorid-Ionen (wie z. B. Elmex®, keine gefärbten wie z. B. Signal®!), Zahncreme ohne Fluorid-Ionen (wie z. B. Weleda®), fluoridhaltige Mundspülung, Speisesalzlösung, Natriumfluoridlösung (w = 1 %).
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Eisen(III)-chlorid-6-H2O | H290-H302-H315-H318 | P280-P305+P351+P338 |   |
| Ammoniumthiocyanat | H332-H312-H302-H412-EUH032 | -- |  |
| Natriumfluorid | H301-H319-H315-EUH032 | -- |  |
Durchführung
1 mL der Eisen(III)-chloridlösung werden mit 1 mL der Ammonium-thiocyanatlösung in einem Becherglas versetzt und mit demin. Wasser auf 20 mL aufgefüllt. Außerdem wird je 1 cm der beiden Zahncremes in ca. 5 mL dem. Wasser in zwei weitere Bechergläser aufgeschlämmt. Anschließend werden 6 Reagenzgläser etwa 1-2 cm hoch mit der Eisen(III)-thiocyanatlösung gefüllt und jeweils 5 Tropfen der Lösungen der Haushaltsprodukte hinzugegeben. Außerdem wird in ein Reagenzglas Natriumfluoridlösung, in ein weiteres dem. Wasser hinzugetropft. Das Reagenzglas mit Natriumfluoridlösung dient hier als Vergleichsprobe, das Reagenzglas mit dem. Wasser als Blindprobe.
Beobachtung
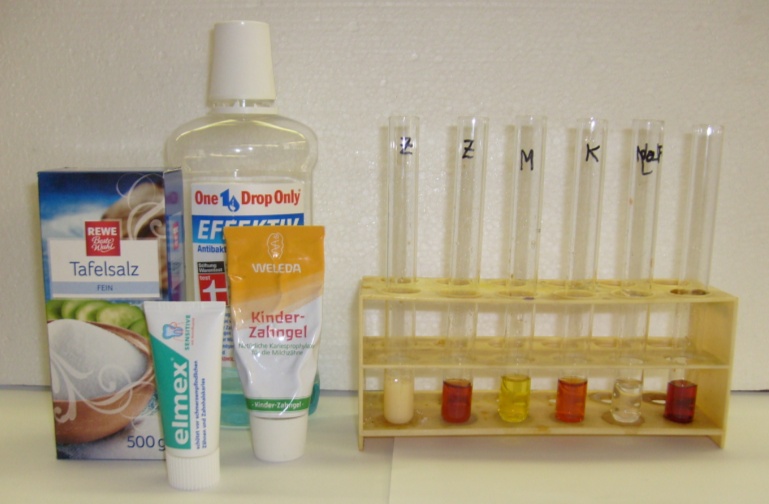
Die Farbe der Nachweisreagenzlösung verändert sich. Die Reagenzlösung ist tiefrot und ändert nach der Zugabe von Zahncreme mit Fluorid-Ionen die Farbe nach hellgelb (siehe Abb. 1, 1. Reagenzglas von links), nach Zugabe von Mundspülung wird sie gelb (siehe Abb. 1, 3. Reagenzglas von links), nach Zugabe von Speisesalz hellt sie sich etwas auf (siehe Abb. 1, 4. Reagenzglas von links). Nach Zugabe der Natriumfluoridlösung entfärbt sie sich (siehe Abb. 1, 5. Reagenzglas von links), während sie nach der Zugabe von Zahncreme ohne Fluorid-Ionen (siehe Abb. 1, 2. Reagenzglas von links) und dem. Wasser (siehe Abb. 1, 6. Reagenzglas von links) unverän- dert bleibt.
Deutung
Die Eisen(III)-Ionen bilden zusammen mit den Thiocyanat-Ionen eine rote wasserlösliche Verbindung. Bei der Zugabe von fluoridhaltigen Lösungen werden die Thiocyanat-Ionen von den Fluorid-Ionen aus der Verbindung verdrängt. Dadurch entfärbt sich die Lösung, hellt sich auf oder verändert die Farbe nach gelb. Fluorid-Ionen lassen sich also mit einer Lösung aus Eisen(III)-Ionen und Thiocyanat-Ionen nachweisen.
Entsorgung
Die Entsorgung erfolgt im Schwermetall-Abfall. Restliche Natriumfluoridlösung muss verdünnt werden, mit Natriumhydrogencarbonat neutralisiert werden und anschließend mit Calciumhydroxid versetzt werden. Das entstehende Calciumfluorid wird abfiltriert und im Säure-Base-Abfall entsorgt, das Filtrat wird ins Abwasser gegeben.
Im Unterricht kann der Versuch als Erarbeitungsversuch bei der Thematisierung von Nach- weisreaktionen oder bei der Behandlung der Elementfamilie der Halogene eingesetzt wer- den.
Er kann alternativ auch mit chlorid- oder iodidhaltigen Alltagsprodukten wie z. B. Speisesalz ohne Fluorid-Ionen durchgeführt werden, um zu zeigen, dass er ausschließlich ein Nachweis von Fluorid-Ionen ist.
Literatur
D. Wiechoczek, Professor Blumes Bildungsserver für Chemie, http://www.chemieunterricht.de/dc2/haus/v096.htm, 08.02.2007 (Zuletzt abgerufen am 08.08.2015 um 10:23 Uhr).G. Schwendt, Noch mehr Experimente mit Supermarktprodukten, WILEY-VCH, 2003, S. 200.
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.