| Thema: Quantitative Analyse von Kohlenwasserstoffen | Tags: Gasgesetz, Kohlenwasserstoff, Analyse | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
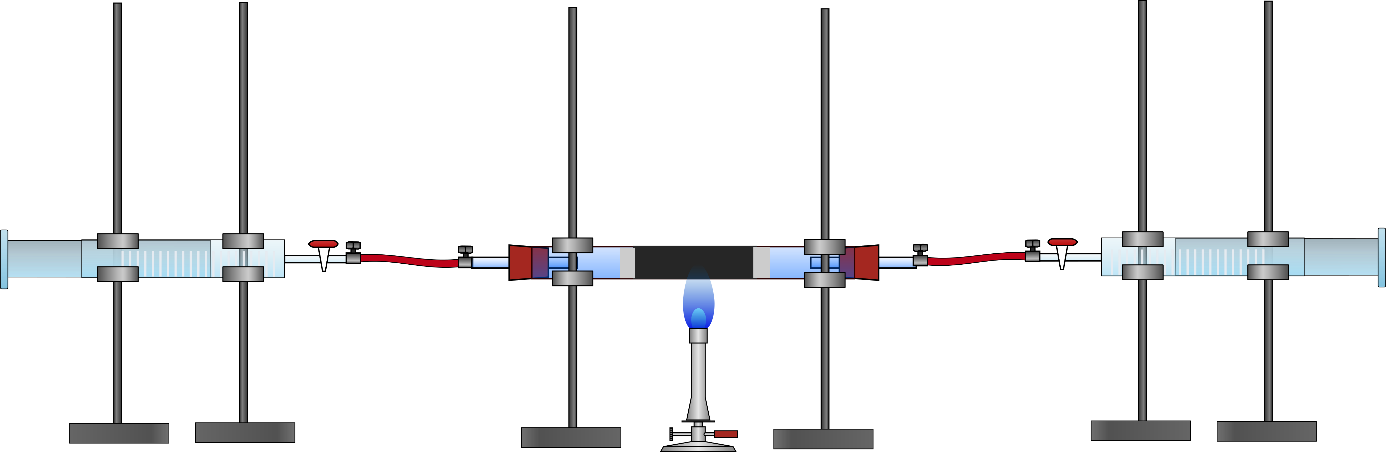
2 Kolbenprober, Schlauchstücke, Schlauchschellen, Verbrennungsrohr, Glaswolle, Bunsenbrenner
Chemikalien
Butan, Kupfer(II)-oxid
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Kupfer(II)-oxid | H302-H410 | P273-P301+P312 |   |
| Butan | H220 | -- |   |
Durchführung
Zunächst wird das Kupfer(II)-oxid querschnittsfüllend in das Verbrennungsrohr gegeben und dieses rechts und links mit Glaswolle verschlossen. Nun werden die Kolbenprober an beiden Seiten über Stopfen mit Glasröhrchen mit dem Verbrennungsrohr verbunden. In den einen Kolbenprober werden 20 mL Butangas gefüllt und dieser wird wieder an das Verbrennungsrohr geschlossen (s. Abb. 1). Nun wird das Kupfer(II)-oxid bis zum Glühen erhitzt und bei weiterem Erhitzen wird mehrmals vorsichtig das Butangas über das Kupfer(II)-oxid geleitet bis keine Volumenveränderung mehr erkennbar ist. Nach Abkühlen der Apparatur wird am Kolbenprober das Volumen abgelesen.
Beobachtung
Beim Überleiten des Gases über das glühende Kupfer(II)-oxid vergrößert sich das Volumen im Kolbenprober. Am Ende des Versuchs wurde ein Volumen von 76 mL erreicht. Zudem ist eine rötliche Verfärbung des vorher schwarzen Kupferoxids zu erkennen.
Deutung
Das Kupferoxid oxidiert das Butangas und es entstehen Kohlenstoffdioxid, Wasser und elementares Kupfer.
Reaktionsgleichung: : CxHy + z CuO → x CO2 + ½ y H2O + z Cu
Pro Mol des eingesetzten Kohlenstoffs entstehen also so viel Mol Kohlenstoffdioxid wie Kohlestoffatome im Gas vorhanden sind. Nun ergibt sich folgende Berechnung:
nCxHy / nCO2 = 1/x → x = nCO2 / nCxHy und da n = V / Vm → x = VCO2 / VCxHy = 76 mL / 20 mL = 3,8 ≈ 4
Das Gas enthält 4 Kohlenstoffatome, es handelt sich folglich um Butan.
Fehlerbetrachtung:
Mögliche Fehlerquellen bei diesem Versuch könnten sein, dass die Apparatur undicht war und somit ein Teil des Butan-Gases entwichen ist. Denkbar ist außerdem, dass die Verbindungen nicht vollständig reagiert haben, was dazu führen würde, dass weniger Kohlenstoffdioxid entsteht als angenommen. Dies würde zur Berechnung einer geringeren Anzahl an Kohlenstoffatomen führen.
Absoluter Fehler:
Δabs = ∣xLit − xMess∣ = ∣4 − 3,8∣ = 0,2
Relativer Fehler:
Δrel = (Δabs / xLit )⋅100 % = (0,2 / 0,4) ⋅100 % = 5 %
Entsorgung
Das entstandene Kupfer kann mit Luftsauerstoff unter Erhitzen wieder zu Kupfer(II)-oxid oxidiert und wiederverwendet werden.
Literatur
W. Glöckner, W. Jansen, R.G. Weissenhorn (Hrsg.), Handbuch der experimentellen Chemie – Sekundarstufe II, Band 9: Kohlenwasserstoffe, Alius Verlag Deubner, 2005, S. 58 ff
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.