| Thema: Quantitative Analyse von Kohlenwasserstoffen | Tags: Gasgesetz, Molare Masse, Analyse | Klassenstufen: 11-12 | Versuchsart: SV |
Materialien
Kolbenprober, Schlauchstücke, Schlauchschellen, Wasserbad, Einhalsrundkolben, Olive
Chemikalien
n-Pentan
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| n-Pentan | H225-H304-H336-H411-EUH066 | -- |     |
Durchführung
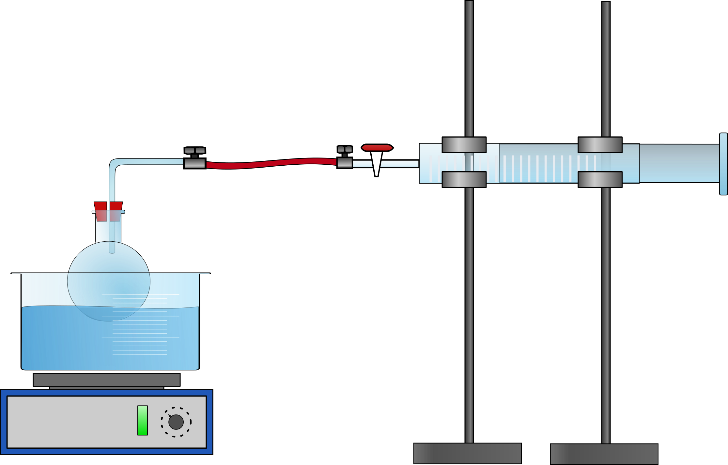
Zunächst werden 0,3 mL des n-Pentans in den Einhalsrundkolben gegeben und über eine Olive und ein Schlauchstück mit dem Kolbenprober verbunden. Nun wird der Rundkolben so weit wie möglich in das Wasserbad getaucht und das Wasserbad erhitzt (s. Abb. 1). Nach Verdampfen des n-Pentans wird das Volumen am Kolbenprober abgelesen. Zudem werden die Temperatur des Wasserbades und der Luftdruck notiert.
Beobachtung
Beim Erhitzen des Wasserbades verdampft das n-Pentan und es ist eine Volumenvergrößerung am Kolbenprober zu beobachten. Das Volumen beträgt 68 mL.
Deutung
Das Pentan hat einen Siedepunkt von ungefähr 36 °C und verdampft bei höheren Temperaturen. Somit ist eine Volumenänderung sichtbar, da gasförmige Stoffe mehr Volumen einnehmen als Flüssigkeiten. Mit Hilfe des idealen Gasgesetzes lässt sich nun die molare Masse des n-Pentans bestimmen.
p·V = n·R·T = (m/M)·R·T → M = (m·R·T)/(p·V)
R = 8,3144 (kPa∙L)/(K∙mol); p = 101,3 kPa; T = 323,15 K; V = 0,068 L
m = p∙V = 0,626 g/mL · 0,3 mL = 0,1878 g
M = 70,98 g/mol
Der ermittelte Wert für die molare Masse des n-Pentans entspricht ungefähr dem Literaturwert von 72,15 g/mol.
Fehlerbetrachtung:
Eine mögliche Fehlerquelle bei diesem Versuch könnte sein, dass die Verbindung zwischen Kolbenprober und Rundkolben undicht ist, wodurch Gas entweichen kann. Außerdem könnte der Luftdruck vom Standarddruck abweichen oder die Temperatur des Wasserbades ungenau abgelesen worden sein.
Absoluter Fehler:
Δabs = |xLit − xMess| = |72,15 − 70,98| = 1,17
Relativer Fehler:
Δrel =(Δabs /xLit) ⋅100 % = (1,17 / 72,15) ⋅ 100 % = 1,62 %
Entsorgung
Das n-Pentan kann in den Behälter für organische Lösungsmittel entsorgt werden.
Literatur
W. Glöckner, W. Jansen, R.G. Weissenhorn (Hrsg.), Handbuch der experimentellen Chemie – Sekundarstufe II, Band 9: Kohlenwasserstoffe, Alius Verlag Deubner, 2005, S. 66 f
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.