| Thema: Quantitative Analyse von Kohlenwasserstoffen | Tags: Liebig, Analyse, Kohlenwasserstoff | Klassenstufen: 11-12 | Versuchsart: SV |
Materialien
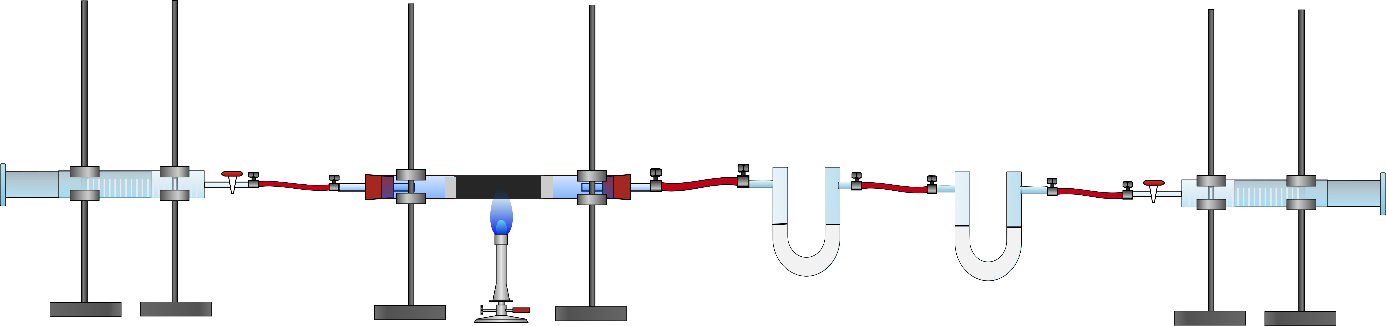
2 Kolbenprober, Verbrennungsrohr, 2 U-Rohre, Glaswolle, Bunsenbrenner, Schlauchstücke, Porzellanschiffchen
Chemikalien
Butan, Kupfer(II)-oxid, Calciumchlorid, Natriumhydroxid
Durchführung
Zu Beginn werden jeweils die U-Rohre und die zugegebene Menge an Calciumchlorid bzw. Natriumhydroxid abgewogen und die Werte notiert. Dann wird in das Glasrohr zwischen zwei Glaswollestücken Kupfer(II)-Oxid gegeben. Der Kolbenprober wird mit dem Verbrennungsrohr verbunden. Die andere Seite des Verbrennungsrohres wird mit zwei U-Rohren verbunden. In dem ersten U-Rohr befindet sich Calciumchlorid, in dem zweiten feines Natriumhydroxid, welches durch Mörsern von Natriumhydroxidplätzchen hergestellt wurde. Das zweite U-Rohr wird zusätzlich an einen weiteren Kolbenprober geschlossen. Nun wird einer der Kolbenprober mit 20 ml Butangas befüllt, wieder verschlossen und wieder an das Verbrennungsrohr geschlossen. Das Kupferoxid wird zum Glühen gebracht und anschließend wird das Butangas über das erhitzte Kupferoxid geleitet. Nach Abkühlen wird die Apparatur abgebaut und die U-Rohre erneut gewogen.
Beobachtung
Leider hat der Versuch nicht gut funktioniert, weshalb im Weiteren theoretisch erörtert wird, was hätte passieren müssen. Bei beiden U-Rohren ist eine Massenzunahme erkennbar. Das U-Rohr mit dem Calciumchlorid wiegt nun 0,05 g mehr, wobei eine Gewichtzunahme um 0,077 g zu erwarten war. Das U-Rohr mit dem Natriumchlorid wiegt 0,04 g mehr, wobei eine Gewichtszunahme um 0,15 g zu erwarten war. Im Folgenden wird mit den zu erwarteten Werten weiter gerechnet.
Deutung
Das Kupferoxid oxidiert das Butangas und es entstehen Kohlenstoffdioxid, Wasser und elementares Kuper. Reaktionsgleichung: : CxHy + z CuO x CO2 + ½ y H2O + z Cu Aus der Beziehung für die molare Masse n= m/M ergibt sich folgendes: Nach dem Erhitzen ist das U-Rohr mit dem Natriumhydroxid um 0,09 g schwerer, somit folgt: Es werden je zwei Wasserstoffatome aus dem unbekannten Gas benötigt, um ein Wassermolekül zu ergeben. Das U-Rohr mit dem Calciumchlorid ist um 0,05 g schwerer, wodurch sich folgendes ergibt: Nun wird das Verhältnis von C- und H-Atomen berechnet: Somit sind im Butan wie zu erwarten 4 C-Atome und 10 H-Atome enthalten. Fehlerbetrachtung: Ein möglicher Grund für die großen Abweichungen der gemessenen und der zu erwarteten Werte ist, dass die Apparatur undicht gewesen sein könnte und somit die Gase entwichen sin können. Außerdem ist es möglich, dass die Verbindungen nicht vollständig reagiert haben und somit nicht das gesamte Butangas zu Wasser und Kohlenstoffdioxid umgesetzt wurde. Zusätzlich ist es möglich, dass die Substanzen, welche das Wasser und das Kohlenstoffdioxid absorbieren sollten, dieses nicht vollständig getan haben, wodurch ebenfalls Abweichungen entstanden sein können.
Entsorgung
Die Entsorgung des Calciumchlorids und des Kupferoxids erfolgt über den Feststoffabfall. Das Natriumhydroxid kann vorsichtig in Wasser gelöst und in den Säure-Base-Abfall gegeben werden.
Literatur
http://www.seilnacht.com/Lexikon/orgkohl.html (zuletzt aufgerufen am 14.08.2015 um 10:45 Uhr)
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.