| Thema: Katalyse, Photokatalyse | Tags: Photokatalyse, Radikale, Redoxreaktion, ZnO-Nanopartikel | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
4 Bechergläser (100 mL), UV-Lampe (300 W), Stativ
Chemikalien
ZnO-Nanopartikel-Suspension Methylenblau, Dem. Wasser, Ethanol-Lösung
Durchführung
Zur Herstellung einer wässrigen Methylenblau-Lösung werden je 3 Tropfen Methylenblau (c=0,05 mol/L) in 45 mL Wasser bzw. in 45 mL Ethanol gegeben und vermengt. 5 mL der jeweiligen Methylenblau-Lösungen werden mit 5 mL einer ZnO-Nanopartikel-Suspension versetzt. Die Suspensionen werden anschließend für eine halbe Stunde mit UV-Licht bestrahlt.
Beobachtung
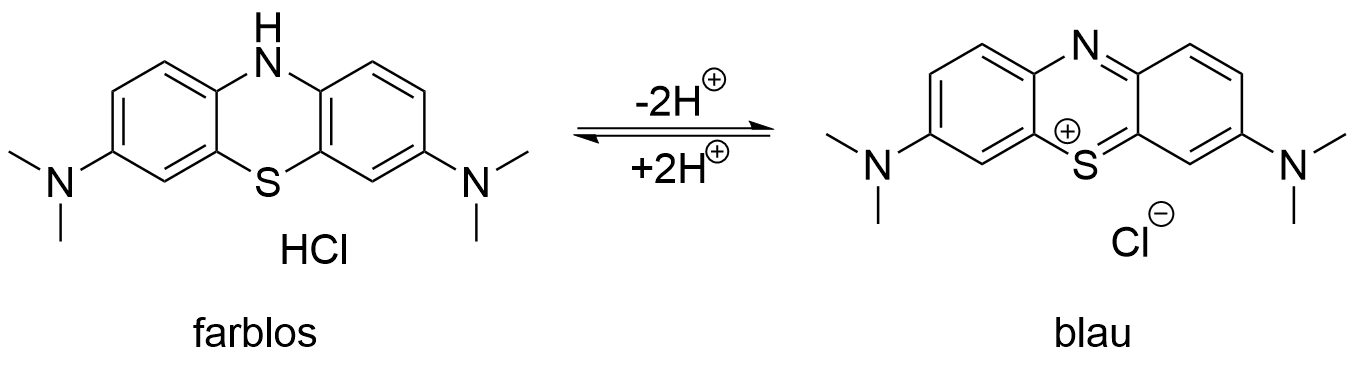
Nach Zugabe der Methylenblau-Wasser-Lösung zur ZnO-Suspension fällt ein weißer Feststoff aus. Nach der Belichtung ist die Lösung farblos. Die mit Methylenblau-Ethanol-Lösung versetzte ZnO-Nanopartikel-Suspension hat sich nicht vollständig entfärbt. Eine leichte hellblaue Färbung ist weiterhin zu erkennen, welche zum Vergleich der Ausgangslösung heller ist. In dieser Lösung ist auch nach der Belichtung kein Feststoff ausgefallen.
Deutung
In Wasser wachsen die Zinkoxid-Nanopartikel, sodass diese am Boden ausfallen. Dieses Partikelwachstum verläuft nach dem Prinzip der Ostwald-Reifung, indem die kleinsten Teilchen sich zugunsten der größeren Teilchen auflösen. Mithilfe des Ethanols soll diese Reifung verhindert werden. Allerdings löst sich im Ethanol weniger Sauerstoff, der wiederum für die Oxidation der Nanopartikel von Bedeutung ist.
Die Zinkoxid-Nanopartikel dienen als Photokatalysatoren und können unter Einwirkung von UV-Licht organische Verbindungen, wie Methylenblau, abbauen. Durch die Einwirkung von Strahlung, deren Energie größer ist als die der Bandlücke des Halbleiters ZnO, können Elektronen angeregt und von dem Valenz- in das Leitungsband transferiert werden. Es entstehen sogenannte Elektron-Loch-Paare, bestehend aus den Elektronen im Leitungsband (eLB-) und Elektronenfehlstellen im Valenzband (hVB+). Moleküle wie Wasser oder Hydroxid-Ionen, die an der ZnO-Partikeloberfläche adsorbiert sind, können zu verschiedenen Radikalen oxidiert und reduziert werden.
hVB+ + H2O → OH· + H+
hVB+ + OH- → OH·
eLB- + O2 + H+ → HO2-·
Die entstehenden Radikale reagieren im Anschluss mit dem Methylenblau, welches vollständig zu Kohlenstoffdioxid und Wasser zersetzt wird.
Wie bereits oben erwähnt, ist die Sauerstoffkonzentration in der ethanolischen Lösung geringer als in der wässrigen Lösung, wodurch der Sauerstoff nicht an der Oberfläche der Nanopartikel reduziert werden kann. Stattdessen wird Methylenblau von der Oberfläche der ZnO-Nanopartikel adsorbiert und nimmt in das Leitungsband promovierte Elektronen auf. Dadurch wird das Methylenblau, wie im Falle der wässrigen Lösung, nicht zersetzt, sondern reduziert und somit in die Leukoform überführt, weshalb es farbloserscheint . Bei Einleitung von Sauerstoff in die Lösung kommt es wiederum zur Oxidation des Methylenblaus und dieses erscheint blau. Daher ist die Lösung am oberen Rand intensiver blau gefärbt als am Boden des Becherglases. Durch Schütteln wird der Sauerstoff in der gesamten Lösung verteilt, woraufhin diese sich vollständig blau färbt.
Entsorgung
Die Lösungen können über das Abwasser entsorgt werden.
Literatur
[1] T. Wilke, Anorganisches Grundpraktikum für Lehramtskandidaten „Nanoversuche“, WiSe 2013/14 [2] A. Steinkuhle, Bachelorarbeit - Synthese und Charakterisierung von Zinkoxid-Nanopartikeln für Schulexperimente, S. 37 ff..
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.