| Thema: Eigenschaften von ungesättigten Kohlenwasserstoffen | Tags: Doppelbindung, Alkene, Bromwasser, Nachweis, elektrophile Addition, ungesättigte Kohlenwasserstoffe | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
Reagenzgläser, Reagenzglasständer, Stopfen, Pipette
Chemikalien
Brommwasser, Cyclohexan, Cyclohexen, Tomatensaft, Speiseöl
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Brom | H330-H314-H400 | -- |    |
| Cyclohexan | H225-H304-H315-H336-H410 | -- |     |
| Cyclohexen | H225-H302-H304-H411 | P210-P243-P280-P273-P301+P330+P331-P309+P310 |     |
Durchführung
Aufgrund der Verwendung von Bromwasser unterm Abzug arbeiten!
In 4 Reagenzgläsern werden jeweils 2-3 mL Tomatensaft, Cyclohexan, Cyclohexen und Speiseöl gegeben. Anschließend wird jeweils etwas Bromwasser hinzu getropft.
Beobachtung
Im Reagenzglas mit Cyclohexan entfärbt sich das Bromwasser nicht. Im Reagenzglas mit dem Cyclohexen entfärbt sich die bräunliche Färbung des Bromwassers. Im Reagenzglas mit dem Tomatensaft ist eine Farbveränderung zu beobachten. Nachdem Bromwasser hinzugegeben wurde ist ein Farbumschlag nach gelb zu beobachten, diese Farbe ändert sich allmählich hin zu grün. Im Reagenzglas mit dem Speiseöl entfärbt sich das bräunliche Bromwasser ebenfalls.
Deutung
Zur Vereinfachung wird der Reaktionsmechanismus der elektrophilen Addition anhand vom Brom-Molekül und nicht vom Bromwasser dargestellt. Das Brom-Molekül kann sich über eine elektrophile Addition an die Doppelbindung des Cyclohexens anlagern. Durch die Reaktion entfärbt sich die Lösung, da die Brommoleküle für das Bromwasser farbgebend sind.
Cyclohexan reagiert nicht über diesen Mechanismus, da es keine Doppelbindungen besitzt und die bräunliche Farbe des Bromwassers bleibt erhalten.
Auf diesem Wege können somit Doppelbindungen in einer Verbindung nachgewiesen werden. Dadurch, dass sich Tomatensaft und Speiseöl ebenfalls entfärben, kann darauf geschlossen werden, dass Kohlenwasserstoffe mit Doppelbindungen in den Flüssigkeiten vorhanden sind.
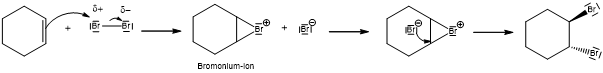
Bei einer elektrophilen Addition tritt die Doppelbindung des Alkens in Wechselwirkung mit dem Brom-Molekül, wodurch das Brom-Molekül polarisiert wird. Es entsteht ein induzierter, temporärer Dipol. Diese Polarisierung geschieht aufgrund der hohen Elektronendichte der Doppelbindung, da sich die Elektronenräume der π-Bindung und des Brommoleküls überlappen. Das Brom-Molekül wird heterolytisch gespalten. Ein Bromatom übernimmt die Bindungselektronen und wird zum Bromidion. Das so entstandene Bromkation ist sehr reaktiv und greift elektrophil die Doppelbindung an. Als Zwischenstufe bildet sich das cyclische Bromoniumion, welches auch oft σ-Komplex genannt wird. Im Folgeschritt erfolgt der nucleophile Angriff des abgespaltenen Bromanions von der dem Komplex abgewandten Seite, da durch die Bromoniumbrücke der Angriff auf der einen Seite sterisch gehindert ist. Je nachdem, an welches beteiligte Kohlenstoffatom sich das Bromidionn beim Angriff orientiert, lockert sich die π-Br+-Bindung und wird entsprechend zum Ladungsausgleich umgelagert (Mechanismus siehe Abb. 3). Es entsteht ein trans-Additionsprodukt.
Entsorgung
Die Lösungen der Halogene werden mit Natriumthiosulfat-Lösung zu den entsprechenden Halogeniden reduziert. Das Reaktionsgemisch gibt man nach einer Neutralisation mit Natriumhydrogencarbonat ins Abwasser.
Literatur
Blume, R., http://www.chemieunterricht.de/dc2/ch/chv-010.htm (zuletzt abgerufen am 04.08.2016, um 09.45 Uhr)
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.