| Thema: Alkanone und Alkanale | Tags: Aldehyde, Zucker, Tollens, Nachweis, Redoxreaktion, Silberspiegel | Klassenstufen: 11-12 | Versuchsart: SV |
Materialien
100 mL-Becherglas, Tropfpipetten, Reagenzgläser, Wasserbad
Chemikalien
Silbernitratlösung, Ammoniaklösung, Acetaldehyd, Butan-2-on, Natronlauge, destilliertes Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Silbernitratlösung (w = 5 %) | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
| Ammoniaklösung (w = 10 %) | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
| Natronlauge | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
| Butan-2-on | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
| Acetaldehyd | H224-H351-H319-H335 | -- |    |
Durchführung
Herstellen des Tollens-Reagenz
Zu 20 mL einer Silbernitratlösung (w = 5 %) wird so lange tropfenweise Ammoniaklösung hinzugegeben, bis sich der entstandene Niederschlag gerade wieder löst. Dann werden einige Tropfen Natronlauge hinzugegeben.
Nachweis des Aldehyds
In drei Reagenzgläser werden die folgenden Lösungen eingefüllt: Reagenzglas I wird mit 3 mL destilliertem Wasser gefüllt, Reagenzglas II mit 3 mL Butan-2-on und Reagenzglas III mit 3 mL Acetaldehyd. Nun wird zu den Lösungen in den Reagenzgläsern I-III jeweils 5 mL Tollens-Reagenz gegeben. Nach Zugabe des Tollens-Reagenz werden die Reagenzgläser kurz geschüttelt und unter dem Abzug im Wasserbad für etwa 10 Minuten erhitzt. Die Temperatur des Wasserbades sollte bei mindestens 70 °C liegen.
Beobachtung
Bei den Lösungen in den Reagenzgläsern I und II ist nach Zugabe des Tollens-Reagenz keine Veränderung festzustellen. Auch beim Erhitzen im Wasserbad ist keine weitere Veränderung zu beobachten.
Wird Tollens-Reagenz zu der Lösung in Reagenzglas III gegeben, ist ebenfalls zunächst keine Veränderung zu beobachten. Beim Erhitzen der Probe im Wasserbad entsteht allerdings schnell ein dukelbrauner bis schwarzer Niederschlag. Nach etwa 10 - 15 Minuten im Wasserbad kann beobachtet werden, dass sich ein Silberspiegel an der Innenwand des Reagenzglases gebildet hat.

Deutung
Beim Herstellen des Tollens-Reagenz löst sich der Niederschlag durch Komplexierung der Silberionen auf. Es bildet sich ein Silberdiammin-Komplex, der in Wasser leicht löslich ist.
Ag+/sup>(aq) + 2 NH3(aq) → [Ag(NH3)2]+(aq)
Dieser Komplex verhindert auch, dass im basischen Milieu schwerlösliches Ag2O gebildet wird.
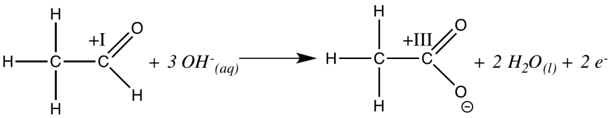
Die Entstehung eines schwarzen Niederschlags, der später einen Silberspiegel an der Gefäßwand bildet, lässt darauf schließen, dass bei der Reaktion des Tollens-Reagenz mit dem Aldehyd elementares Silber entstanden ist, Silber also reduziert wurde. Demnach wird der Aldehyd zur Carbonsäure oxidiert. Die Oxidation läuft analog zur Fehling-Probe nach folgender Gleichung ab.
Oxidation: Abbildung einfügen
Bei der Reduktion wird elementares Silber gebildet.
Reduktion: 2Ag+(aq) + 2e- → 2Ag(s) ↓
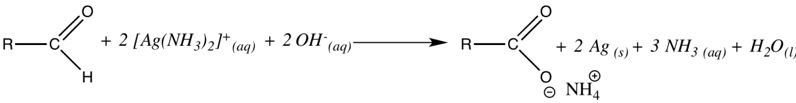
Insgesamt kann damit die folgende Reaktionsgleichung aufgestellt werden.
Gesamt: Abbildung einfügen
Entsorgung
Die Entsorgung der Lösung erfolgt über die organischen Lösungsmittel. Reste des Tollens-Reagenz können über die anorganischen Lösungen entsorgt werden. ACHTUNG: eigenständig erneut informieren, da Gefahr von Bildung explosiver Silberverbindungen!
Literatur
[1] Wollrab, A., Organische Chemie – Eine Einführung für Lehramts- und Nebenfachstudenten, 4. Aufl., Springer-Verlag, Berlin, Heidelberg, 2014, Seiten 544-545[2] Blume R., Prof. Blumes Bildungsserver für Chemie; http://www.chemieunterricht.de/dc2/haus/v021.htm; zuletzt geöffnet am 06.08.2016 um 17:18
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.