| Thema: Kunststoffe | Tags: Polykondensation | Klassenstufen: 11-12 | Versuchsart: LV |
Materialien
Becherglas, Haken, eventuell Glasstab, Pasteurpipette
Chemikalien
Adipinsäuredichlorid, Cyclohexan, Natriumhydroxid, Hexamethylendiamin, dest. Wasser
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Hexamethylendiamin | H312-H302-H335-H314 | -- |   |
| Adipinsäuredichlorid | Leider in der Datenbank nicht gefunden - bitte nachschlagen! | ||
| Cyclohexan | H225-H304-H315-H336-H410 | -- |     |
| Natriumhydroxid | H314 | -- |  |
| Wasser | - | - | |
Durchführung
Etwa 1 g des Adipinsäuredichlorids wird in 50 mL Cyclohexan gelöst. Das Hexamethylendiamin (etwa 2 g) wird in 50 mL Wasser gelöst. In die wässrige Lösung wird ebenfalls etwas Natriumhydroxid gegeben und anschließend mit der organischen Lösung überschichtet. Mit einem Haken oder einer Pinzette kann der an der Grenzfläche entstehende Nylonfaden herausgezogen werden.
Beobachtung
An der Grenzschicht bildet sich ein Faden aus, der herausgezogen und aufgewickelt werden kann.
Deutung
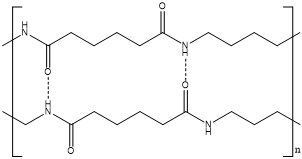
An der Grenzfläche bildet sich Nylon 6,6, welches als Faden gezogen werden kann. Dabei bilden die Monomere des Hexamethylendiamins und des Adipinsäuredichlorids ein Polymer, welches über Peptidbindungen verknüpft ist. Die vorliegende Reaktion ist eine Polykondensation, bei der Chlorwasserstoff frei wird.
Um diese Reaktion regulieren zu können, wird Adipinsäuredichlorid in dem Lösungsmittel Cyclohexan gelöst, während das Hexaethylendiamin in Wasser gelöst wird. Hierdurch wird sichergestellt, dass die beiden Monomere nur an der Phasengrenze von Wasser und Cyclohexan miteinander in Berührung kommen.
Das gelöste Natriumhydroxid dient der Neutralisation des frei werdenden Chlorwasserstoffs, welches als Salzsäure in der wässrigen Phase vorliegt. Die Salzsäure würde zu einer Depolymerisation des gebildeten Polymers führen.
Entsorgung
Das Nylon kann über den Feststoffabfall entsorgt werden. Reste der Lösung werden über den Sammelbehälter für organische Lösungsmittel entsorgt.
Literatur
[1] K. Koszinowski, Anleitung zum Organisch-Chemischen Grundpraktikum, Göttingen: Universität Göttingen, (2016).
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.