| Thema: Klassischer Redoxbegriff | Tags: Sauerstoffübertragung, Kupferoxid, Kupfer | Klassenstufen: 7-8 | Versuchsart: LV |
Materialien
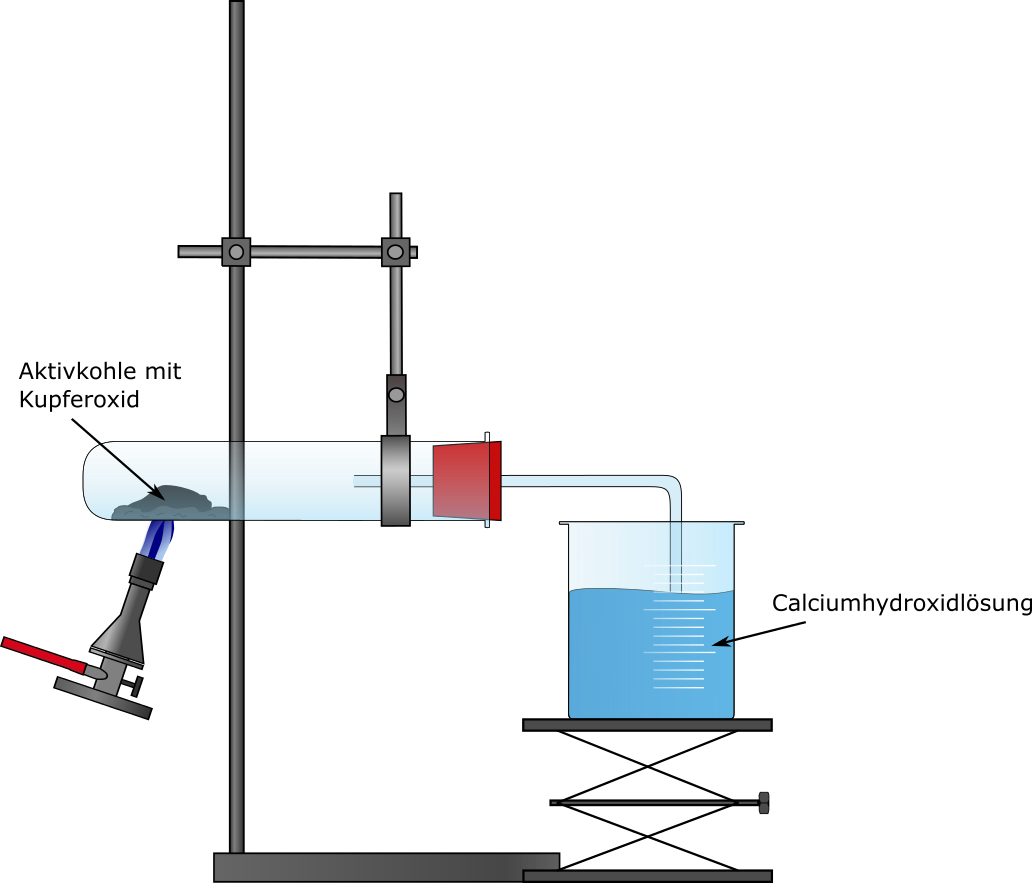
Duran-Reagenzglas, Becherglas, durchbohrter Gummistopfen, gebogenes Glasrohr, Gasbrenner, Stativ und Klemmen
Chemikalien
Kupferoxid, Aktivkohle, Calciumhydroxid
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Kupfer(II)-oxid | H302-H410 | P273-P301+P312 |   |
| Aktivkohle gekörnt | -- | -- | |
| Kalkwasser Lösung | H318 | P280-P305+P351+P338-P309+P310 |  |
| Kupfer | -- | -- | |
| Kohlenstoffdioxid | H280 | P410+P403 |  |
Durchführung
Das Duran-Reagenzglas wird waagerecht mithilfe einer Stativklemme eingespannt. Anschließend wird es mit einem Gemisch aus 2 g Kupferoxid und 0,2 g Aktivkohle befüllt. Das Reagenzglas wird durch den Stopfen verschlossen, welcher von einem gewinkelten Glasrohr durchbohrt wird. Das ableitende Glasrohr endet in einem Becherglas gefüllt mit einer Calciumhydroxid-Lösung (Kalkwasser). Das Reagenzglas wird dann mit dem Gasbrenner erhitzt bis das Gemisch aufglüht. Sobald das Gemisch aufglüht sofort den Stopfen lösen!
Das Entfernen des Stopfens ist nötig, da sich nach Beendigung der Reaktion das Gas in dem Reagenzglas zusammenzieht und ein Unterdruck entsteht der das Kalkwasser ins Reagenzglas saugen würde. Durch den Temperaturunterschied des kalten Wassers und des heißen Glases könnte das Reagenzglas dabei springen.
Beobachtung
Im Reaktionsgemisch ist ein rotes Glühen zu erkennen. Im Kalkwasser zeigt sich ein weißer Niederschlag und nach der Reaktion ist im Reagenzglas ein rotgolden glänzender Stoff zu sehen.
Deutung
Das Kupferoxid wird durch den Kohlenstoff reduziert. Es findet also eine Sauerstoffübertragung vom Kupferoxid auf den Kohlenstoff nachfolgender Reaktionsgleichung statt:
2CuO(s) → O2(g) + 2Cu(s)
C(s) + O2(g) → CO2(g)
Gesamtgleichung: 2CuO(s) + C(s) → CO2(g) + 2Cu(s)
Das entstehende Kohlenstoffdioxid wird mithilfe des Kalkwasser durch Bildung des schwer löslichen Calciumcarbonats nachgewiesen.
CO2(g) + 2Ca(OH)2(aq) → CaCO3(s) + H2O(l)
Entsorgung
Alle verbliebenen Feststoffe können im Feststoffabfall entsorgt werden. Die Calciumhydroxid-Lösung wird neutralisiert und im Ausguss entsorgt.
Literatur
Hamm, J. http://www.hamm-chemie.de/k7/k7ab/red_cuo_c.htm (Zuletzt abgerufen am 26.07.2016)
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.