| Thema: Klassischer Redoxbegriff | Tags: Sauerstoffübertragung, Magnesium, Wasser | Klassenstufen: 7-8 | Versuchsart: LV |
Materialien
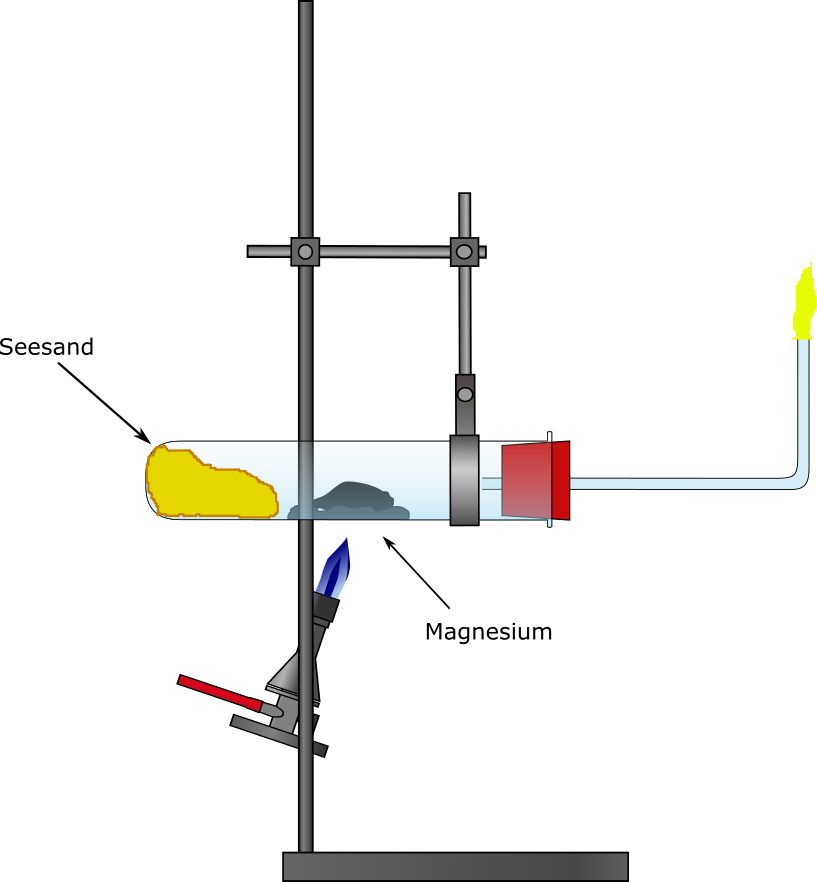
Duran-Reagenzglas, durchbohrter Stopfen, Flammenfalle, Stativ und Klemmen, Gasbrenner, Magnesiarinne
Chemikalien
Magnesium, Wasser, Seesand
Durchführung
Das Duran-Reagenzglas wird mit feuchtem Seesand befüllt und waagerecht mithilfe einer Stativklemme eingespannt. Weiterhin wird etwas Magnesiumpulver auf einer Magnesiarinne in das Reagenzglas gegeben. Anschließend wird das Reagenzglas mit einem durchbohrten Stopfen verschlossen, indem eine Flammenfalle steckt. Das Magnesium wird solange mit dem Gasbrenner erhitzt bis es zu glühen beginnt, dann wird der Sand erhitzt. Das an der Flammenfalle austretende Gas kann mit einem Feuerzeug entzündet werden.
Beobachtung
Das Magnesium hat sich weiß verfärbt, nachdem es ausgeglüht ist. Das an der Flammenfalle entweichende Gas brennt mit einer gelber Flamme.
Deutung
Es findet eine Sauerstoffübertragung vom Wasser auf Magnesium nachfolgender Reaktionsgleichung statt:
2H2O(g) → 2H2(g) + O2(g)
2Mg(s) + O2(g) → 2MgO(s)
Gesamtgleichung: Mg(s) + H2O(g) → MgO(s) + H2(g)
Das Magnesium wird oxidiert, während das Wasser reduziert wird. Dies kann deshalb stattfinden, da die Reaktion von Magnesium mit Sauerstoff sehr hohe Temperaturen erzeugt. Die Reaktion ist exotherm genug, dass sie auch im Wasserdampf weiter abläuft.
Der Wasserstoff wird durch das Anzünden an der Flammenfalle nachgewiesen.
Entsorgung
Die Produkte können über den Hausmüll entsorgt werden.
Literatur
Haußmann, P. http://www.rs-jestetten.de/alte-homepage/sites/02_ueberuns/wasser.pdf, Realschule Jestetten (zuletzt abgerufen am 25.07.2016)
Ähnliche Experimente
Ähnliche Experimente
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.