| Thema: Stickstoff | Tags: Stickstoff, Sauerstoff, Magnesium, Luft | Klassenstufen: 7-8 | Versuchsart: LV |
Materialien
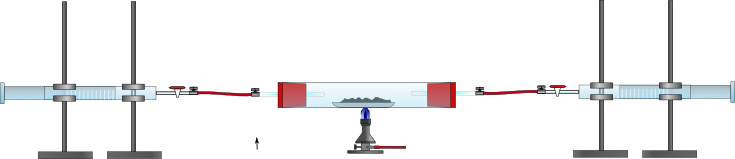
Verbrennungsrohr, durchbohrte Gummistopfen mit Glasrohr, 2 Kolbenprober, Drei-Wege-Hahn, Schlauchverbindungen, Bunsenbrenner Optional: Reagenzglas, UIP (Universalindikator-Papier)
Chemikalien
Magnesium, Luft
| Gefahrstoff | H-Sätze | P-Sätze | GHS |
|---|---|---|---|
| Magnesium | H228-H261-H252 | -- |  |
Durchführung
Die Apparatur wird wie in der Skizze gezeigt aufgebaut. Einer der Kolbenprober wird mit 50 mL Luft befüllt. Dann wird die Apparatur luftdicht verschlossen und das Magnesium mit dem Bunsenbrenner erwärmt. Dabei wird die Luft vorsichtig mehrmals über das Magnesium geleitet, bis die Reaktion abgelaufen ist. Optional: Nach dem Abkühlen wird das Produkt in ein Reagenzglas gegeben und mit Wasser versetzt. Ein feuchtes UIP wird über die Reagenzglasöffnung gehalten.
Beobachtung
Das Magnesium leuchtet stark auf, wenn man Luft darüber leitet. Nach dem Abkühlen kann man sehen, dass das Volumen der Luft abgenommen hat und nun 37 mL beträgt. Das Reaktionsprodukt ist teilweise weiß und teilweise grünlich-grau. Optional: Das Produkt löst sich in Wasser unter Bläschenbildung. Das entstehende Gas riecht nach Ammoniak und färbt ein feuchtes UIP blau.
Deutung
Während des Versuchs haben 13 mL Luft mit Magnesium reagiert. Dies übersteigt das Verhältnis von Sauerstoff in der Luft. Neben dem Sauerstoff hat auch der Stickstoff mit dem Magnesium reagiert. Dies erklärt die unterschiedlichen Farben des Produktes. Bei dem weißen Produkt handelt es sich um Magnesiumoxid, bei dem grün-grauen Produkt um Magnesiumnitrid. Magnesium + Sauerstoff → Magnesiumoxid Magnesium + Stickstoff → Magnesiumnitrid Optional: Beim Lösen des Magnesiumnitrids in Wasser entsteht Ammoniak. Dieser reagiert mit Wasser basisch, weswegen sich das UIP blau färbt.
Entsorgung
Die Reste werden mit Wasser versetzt und über das Abwasser entsorgt.
Literatur
Keune, H. und Boeck, H., Chemische Schulexperimente- Band 1: Anorganische Chemie, Cornelsenverlag, 1. Auflage, 2003, S. 126.
Feedback
Haben Sie Anmerkungen, Feedback oder Kritik zu diesem Experiment? Kontaktieren Sie uns unter Bezugnahme auf diese Seite!
Copyright und Lizenzen: Alle Rechte an den Inhalten dieser eLearning-Materialien liegen beim Autor oder den jeweiligen Urheberrechtsinhabern. Sämtliche Bilder und Texte sind entweder vom Autor selbst fotografiert oder verfasst oder sind gemeinfrei, es sei denn, es ist eine andere Quelle angegeben. Die gesammelten/vollständigen Literaturverzeichnisse der einzelnen Versuche sind jeweils in den entsprechenden Gesamtprotokollen zu finden.
Haftungsausschluss: Die Benutzung der hier vorliegenden Informationen geschieht auf vollkommen eigene Verantwortung. Haftung für Schäden oder Verluste, die beim Umgang mit den hier beschriebenen Stoffen oder bei der Durchführung von chemischen Versuchen entstehen, ist ausgeschlossen; ebenso wie Schadensersatzforderungen oder Gewährleistungsansprüche aufgrund falscher oder fehlender Angaben. Die Angaben zu den Stoffen und die Experimentieranleitungen wurden jedoch sorgfältig und nach bestem Gewissen erstellt und sind in jedem Falle zu beachten.